|
Krankheitsbilder Symptome Folgeerscheinungen Entstehungsgeschichte Untersuchungsmethoden Therapien Arzt-Patienten-Verhältnis Genetik |
[ ] [ ] [ ] [ ] [ ] [ ] [ ] » |








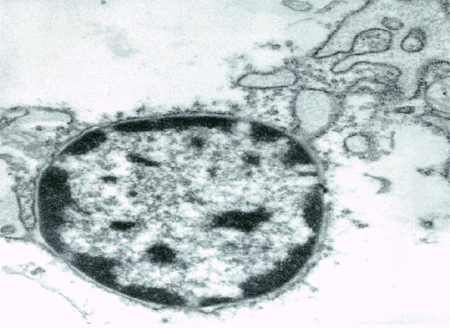
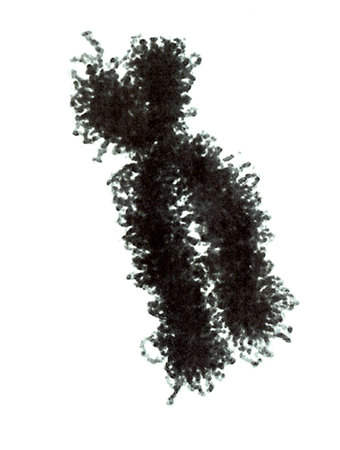
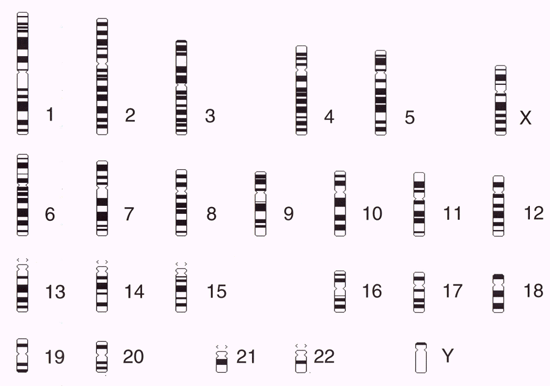
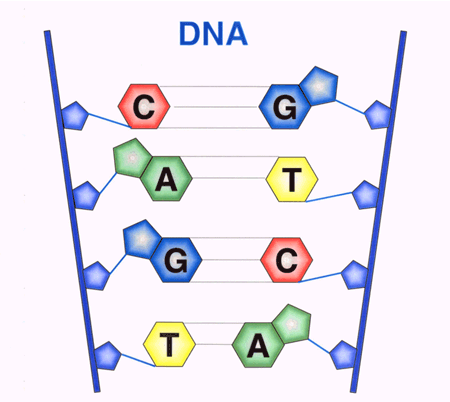
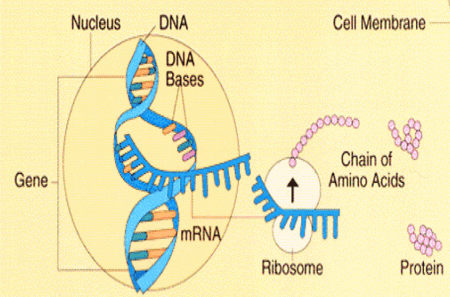
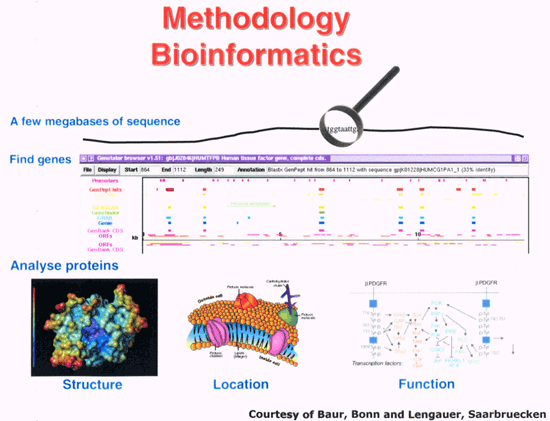
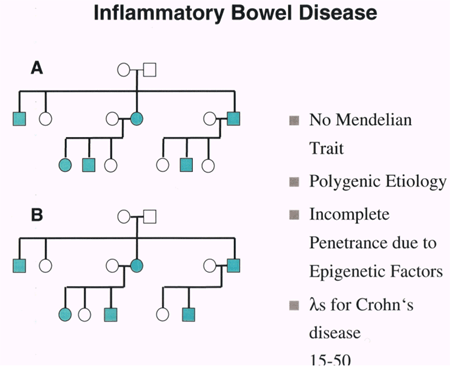
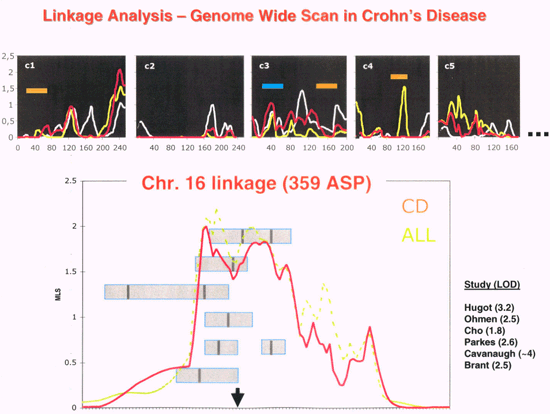
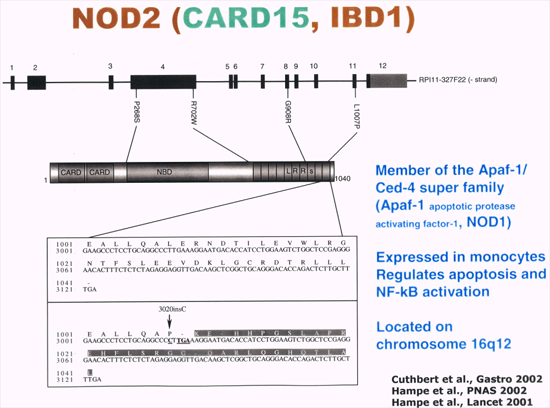
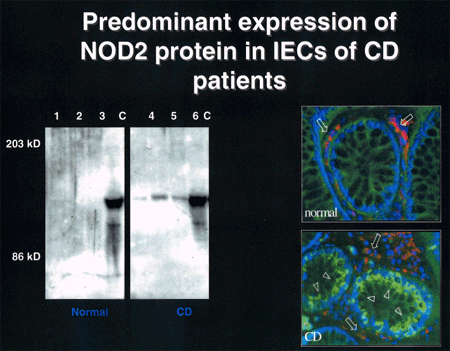
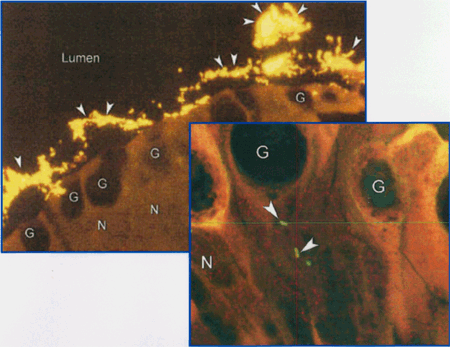
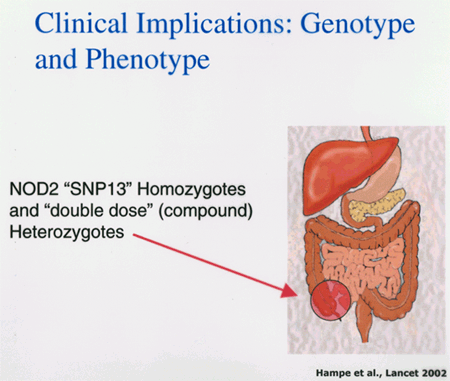
Genetik Autoren: Prof. Andreas Raedler, Martina Spehlmann Die Genetik ist ein Wissenschaftsgebiet, das in den letzten Jahren enorm an Bedeutung zugenommen hat. Wir wissen heute, dass der Bauplan für den gesamten Organismus in dem Zellkern der mit dem Spermium fusionierten Eizelle vollständig vorliegt. Bei jeder Zellteilung (im Rahmen der Entstehung des Embryos bzw. Fötus) wird der gesamte Bauplan an jede Körperzelle weitergegeben. In jeder Entwicklungsphase des Organismus d.h. bei jeder Spezialisierung der Zellen werden bestimmte Teile des Bauplans aktiviert und benutzt. Zellkern und Chromosomen Der Bauplan ist in den Chromosomen des Zellkerns aufgezeichnet. Während der Zellteilung ordnen sich die 46 Chromosomen der menschlichen Zellen so, dass die beiden Tochterzellen jeweils eine Hälfte des Chromosomensatzes bekommen und daran die komplementäre Hälfte synthetisieren, so dass nach der Zellteilung in beiden Zellen wieder 46 Chromosomen enthalten sind. Männliche Individuen besitzen ein Y-und ein X- Chromosom, weibliche zwei X-Chromosomen (» Abb. 1). Das X-Chromosom wird von der Mutter oder dem Vater geerbt, das Y-Chromosom immer vom Vater. Bei der Verschmelzung des Spermiums mit der Eizelle findet sich im Zellkern der Eizelle ein halber Chromosomensatz mütterlicherseits und ein halber Chromosomensatz väterlicherseits. Diese werden so vermischt, dass neu zusammengesetzte Chromosomen entstehen und dadurch ein neuer Bauplan funktionsfähig wird, der zwar dem väterlichen und dem mütterlichen ähnelt aber doch etwas individuell neues darstellt. DNA-Helix Den berühmten englischen Nobelpreisträgern Watson und Crick gelang vor 50 Jahren die Strukturaufklärung der Chromosomen. Sie konnten zeigen, dass ein Chromosom einem in Schneckenwindungen (Helix) verdrillten Doppelfaden entspricht, der aus vier sich in unterschiedlicher Reihenfolge wiederholenden Nukleotidbasen, der DNA, zusammengesetzt ist. Diese vier Nukeotidbasen sind die vier Buchstaben mit denen unser gesamtes Erbgut buchstabiert, d.h. codiert ist. (» Abb. 2 und » Abb. 3). Jeweils drei Basen (ein Triplet) stehen für eine Aminosäure (Codon). Der Chromosomenfaden ist so lang, dass er von der Erde bis zum Pluto reichen würde. Das genetische Alphabet der vier Nukleotidbasen stellt ein universelles Prinzip dar und wird zur Codierung des Erbgutes aller Lebewesen, also auch von Mäusen, Flechten, Insekten und Pilze benutzt. Diese Nukleotidbasen haben besondere biochemische Eigenschaften: So treten jeweils zwei in privilegierte Wechselwirkung miteinander. Wenn auf dem einen Chromosomenfaden die Nukleotidbasen A und C buchstabiert werden, finden sich auf dem zweiten komplementären Faden die Basen T und G. Der genetische Code Im Human Genome Project wurde die gesamte ACTG-Buchstabenfolge aller menschlichen Chromosomen entschlüsselt. Der größte Teil der Chromosomen scheint keine besondere Bedeutung zu haben. Andere Abschnitte stellen Funktionssignale dar, die den Anfang und das Ende eines abzulesenden Genabschnittes markieren. Diese Genabschnitte sind eine Sequenz von Nukleotidbasen, die einem Eiweißmolekül entsprechen und von der Zelle als Bauplan für einen Eiweißkörper benutzt werden (» Abb. 4). Eiweiße stellen die wichtigsten Struktur- und Funktionsträger des Körpers dar, z.B. Muskelproteine, Antikörper und Verdauungsenzyme. Sie setzen sich im Wesentlichen aus 20 verschiedenen Aminosäuren zusammen. Die vier Buchstaben der DNA werden also in die zwanzig Aminosäuren der Eiweiße umgeschrieben. Die Überschreibung von DNA in Aminosäuren erfolgt durch ein Auseinanderreißen des Doppelfadens der Helix im Bereich des abzulesenden Gens (wie ein aufgezogener Reißverschluss), so dass die DNA hier als Einzelstrang vorliegt. An diesen Einzelstrang werden die komplementären Nukleotidbasen angelagert und der entstandene Nukleotidfaden aus dem Kern ins Zytoplasma transportiert. Entsprechend der Nukleotidsequenz werden jetzt Aminosäuren im Zytoplasma aneinandergefügt, so dass der dem Gen entsprechende Eiweißkörper entsteht (» Abb. 5 und » Abb. 6). Genetisch bedingte Krankheiten Eine Reihe von Erkrankungen sind durch Genmutationen (Punktmutation = eine Aminosäure ist ausgetauscht) bedingt, so z.B. die Bluterkrankheit (bekannt geworden durch den erkrankten Zarewisch, der das fehlerhafte Gen von der seiner Großmutter mütterlicherseits, der Königin Viktoria von England, erbte). Bei der Bluter-Krankheit (Hämophilie A) ist durch eine falsche Base für eine falsche Aminosäure codiert worden, so dass ein nicht ausreichend wirksamer Gerinnungsfaktor VIII entsteht, der seine Funktion bei der Blutgerinnung nicht erfüllt. Da dieses Gen auf dem Chromosom X liegt, können nur Männer erkranken (Frauen haben zwei X-Chromosomen, also meistens noch ein gesundes in Reserve). Die Bluter-Krankheit ist ein Beispiel dafür, dass ein einziger falscher Buchstabe über eine falsche Aminosäure zu einer lebensbedrohlichen Krankheit führt. Andererseits kann die gesamte Evolution von der Amöbe bis zum Menschen als eine Abfolge günstiger Mutationen verstanden werden. Mutationen können auch durchaus zum Vorteil eines Individuums gereichen. Bei der Sichelzellenanämie ist eine Aminosäure des Hämoglobins vertauscht. Das fehlerhafte Hämoglobin erweist sich als resistenter gegenüber der Malaria. Bei der Bildung von Antikörpern während einer Infektion, werden an der Antigenbindungsstelle ständig Mutationen (somatische, keine genetischen Mutationen) geschaffen, so dass der Eiweißkörper an der Antigen-Bindungsstelle solange mutiert, bis er Virus oder Bakterium optimal bindet. Die meisten Erkrankungen des menschlichen Körpers sind keine "ein Gen - eine Krankheit - Kausalitäten" wie die Bluter-Krankheit, sondern - wie Bluthochdruck, Zuckerkrankheit und CED - ein Krankheitsgeschehen mit multigenetischem Hintergrund. Man vermutet, dass ein Ensemble von Genen, die für bestimmte Funktionen des Immunsystems verantwortlich sind, als Mutanten (Varianten) existieren, die für eine erhöhte Entzündungsbereitschaft verantwortlich sind. Wenn ein genetisch offensiv eingestelltes Immunsystem bestimmten Umwelt-Signalen ausgesetzt ist (z.B. Nahrungsmittelzusätze), kann es zum Ausbruch der Erkrankung kommen (» Abb. 8). Genetische Faktoren bei CED Wir wissen aus der familiären Häufung dieser Erkrankungen, dass genetische Faktoren bei der Entstehung der chronisch-entzündlichen Darmerkrankungen eine große Rolle spielen.5 bis 10 % der CED-Patienten haben eine positive Familiengeschichte, d.h. ein oder mehrere Familienmitglieder sind erkrankt. Es wurde berechnet, dass das Risiko für einen Verwandten ersten Grades zu erkranken um den Faktor 10 bei der C. ulcerosa, bzw. um den Faktor 14 beim M. Crohn erhöht ist. In drei Viertel aller CED-Familien tritt die Krankheit konkordant auf, d.h. alle Familienmitglieder haben einen M. Crohn oder eine C. ulcerosa, bei einem Viertel diskordant, d.h. M. Crohn und C. ulcerosa treten in dieser Familie nebeneinander auf. Noch deutlicher wird der genetische Einfluss bei der Untersuchung von Zwillingen mit CED. Sind diese Zwillinge heterozygot, d.h. zweieiig, ist das Risiko des gesunden Zwillings, gleichfalls zu erkranken, wie unter normalen Geschwistern einzuschätzen. Bei eineiigen Zwillingen, definitionsgemäß besitzen diese dieselben Gene, beläuft sich das Risiko, dass beide an einem Crohn erkranken auf über 50 %, etwas weniger im Falle der C. ulcerosa. Daraus lässt sich schließen, dass bei der Entstehung des M. Crohn die Hälfte durch die Gene verantwortet wird, die andere Hälfte durch die Umwelt. Wie kann man die Gene, die für CED verantwortlich sind, auf dem Chromosom finden? Dazu bieten sich zwei Wege an: Man sucht sich bereits bekannte Gene aus, von den man weiß, dass sie für das Immunsystem eine große Bedeutung haben, also z.B. das Gen für TNF oder für die TNF-Andockstelle. Man untersucht dann, ob es bei Crohn-Patienten im Vergleich zur Normalbevölkerung Mutationen in diesem genetischen Abschnitt gibt. So ließen sich z.B. Mutationen des TNF finden, die für mehr Entzündungsbereitschaft verantwortlich wären. Allerdings sind Mutanten unter den bekannten Genen des Immunsystems, die mit CED in einem Zusammenhang stehen, bisher noch nicht gefunden worden. Ein anderer Weg ist die Methode ein "Netz" über die Chromosomen zu werfen, indem man bekannte Genmarker bestimmt, die alle paar tausend Basen voneinander entfernt über das gesamte Genom verteilt sind. Mit Hilfe dieses Verfahrens lässt sich das Erbgut von Familien mit CED analysieren: Bei der Verschmelzung des Spermiums mit der Eizelle werden (wie oben beschrieben) ein halber mütterlicher Chromosomensatz und ein halber väterlicher miteinander vermischt, so dass sich die einzelnen Chromosomen teilweise aus mütterlichem und teilweise aus väterlichen Genen zusammensetzen. Man geht nun davon aus, dass immer große Genbruchstücke ausgetauscht werden, so dass das hypothetische Crohn-Gen immer in der Nähe eines Markers zu finden ist und immer mit diesem zusammen vererbt wird (» Abb. 9). Wenn bei den Familienangehörigen, die von M. Crohn betroffen sind, bestimmte Marker dieses genetischen Netzes gehäuft vorkommen, kann man davon ausgehen, dass in der Nähe dieses Markers ein Gen sitzen muss, das für die Erkrankung verantwortlich ist. Das CARD15-Gen Mit dieser Methode hat man bisher 4 Genorte eingekreist, und zwar auf den Chromosomen 5, 6, 12 und 16. Einen Genort auf dem Chromosom 16 konnte man so exakt lokalisieren, dass man das Gen genau kennt und auch das Eiweißmolekül, das diesem Gen entspricht: Das CARD15-Gen (alter Name: NOD2) (» Abb. 10). Bei der Aufklärung der Funktion dieses Eiweißmoleküls hat man überraschenderweise festgestellt, dass es sich um eine Andockstelle (einen Rezeptor) für bakterielle Zellmembranbestandteile handelt. Dieses Protein ist in der Lage, bakterielle Fragmente abzufangen und aus der Zelle auszuschleusen (» Abb. 11). Das Crohn-spezifische Genprodukt ist eine Variante, die einen Funktionsverlust aufweist. Man muss annehmen dass dieser unspezifische Abwehrmechanismus an den Schleimhautzellen des Darms weniger effektiv arbeitet und dadurch bakterielle Antigene vermehrt in die Darmwand eindringen. Dadurch wird das Immunsystem der Schleimhaut in höherem Maße stimuliert. Es konnte gezeigt werden, dass eine heterozygote Mutation des CARD15-Gens (also nur ein Gen ist mutiert) das Risiko, einen M. Crohn zu bekommen, um den Faktor 2 bis 4 erhöht. Sind beide Gene mutiert, steigt das Risiko um den Faktor 20 bis 40. Nicht alle, sondern nur 20 % der Patienten mit M. Crohn sind positiv im Bezug auf eine CARD15-Variante, im Gegensatz zu Patienten mit C. ulcerosa und der gesunden Normalbevölkerung, die in der Größenordnung von 2 % eine CARD15-Positivität aufweisen. Es konnte gezeigt werden, dass CARD15-positive Patienten durch eine Entzündungs-Lokalisation im Ileum, einen früheren Krankheitsbeginn und eine Neigung zu Strikturen charakterisiert sind (» Abb. 12 und » Abb. 13). Mutationen beider CARD15-Gene (also von der Mutter und vom Vater) steigern die Wahrscheinlichkeit, einen Crohn zu bekommen um das 40-fache. Das bedeutet umgekehrt, dass selbst eine doppelte CARD15-Mutante nicht notwendigerweise zu einer Crohn-Erkrankung führt, sondern viele dieser Homozygoten gesund sind und bleiben. Um an M. Crohn zu erkranken, müssen eben noch andere Gene mutiert sein und die verantwortlichen Umwelteinflüsse hinzutreten. Vieles von dem, was über den genetischen Hintergrund von CED bekannt ist, verdanken wir der Arbeitsgruppe von Prof. Dr. S. Schreiber (Universität Kiel). Wie geht es weiter? Es ist zu erwarten, dass in den nächsten Monaten und Jahren eine Reihe weiterer Crohn- bzw. C. ulcerosa-Gene gefunden werden können. Dadurch werden wir, wie schon die Forschungsergebnisse um das CARD15-Gen gezeigt haben, zu einem sehr viel besseren Verständnis der Pathogenese von CED kommen, aber wahrscheinlich auch zu einer besseren Klassifizierung der verschiedenen klinischen Typen und damit zu einer spezifischeren, individuelleren und effektiveren Therapie (» Abb. 14). |